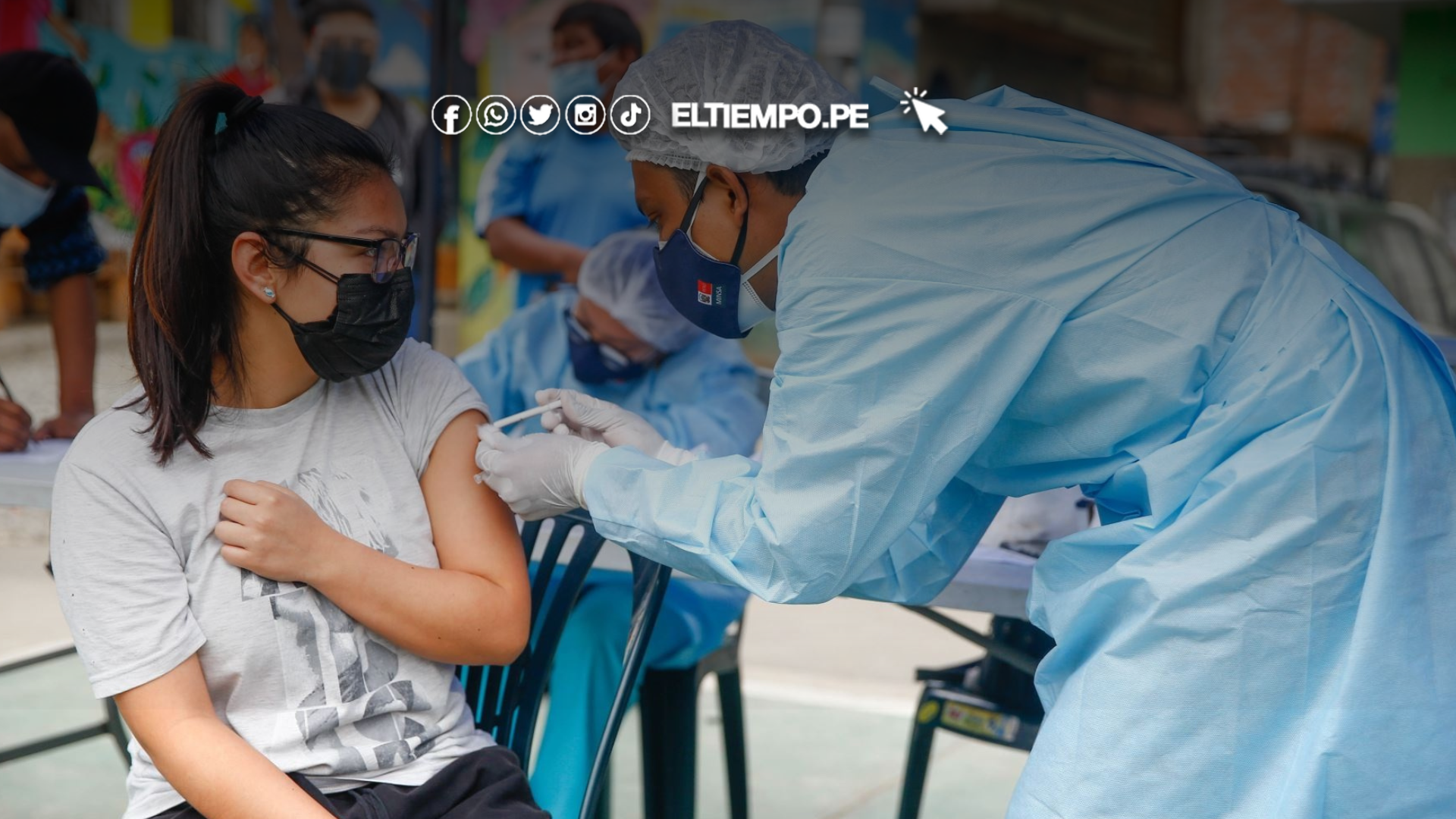
La Administración de Alimentos y Medicamentos de EE.UU. (FDA, por sus siglas en inglés) está cambiando la forma en la que aprueba las vacunas contra el covid-19 para los estadounidenses, un movimiento que podría limitar futuras vacunas a los estadounidenses mayores y personas con mayor riesgo de infección grave por covid-19.
LEER MÁS ► Google presenta probador de ropa con IA: así puedes probar outfits sin ir a la tienda
La agencia está cambiando el tipo de evidencia que aceptará de los fabricantes de vacunas para aprobar vacunas actualizadas contra el covid-19, dijeron el Dr. Vinay Prasad, el nuevo director del Centro de Evaluación e Investigación Biológica de la FDA, y el Comisionado de la FDA, Dr. Marty Makary, en un editorial publicado el martes en el New England Journal of Medicine.
El cambio significa que las vacunas actualizadas probablemente estarán disponibles este otoño para adultos de 65 años o más y aquellos con condiciones subyacentes que puedan ponerlos en mayor riesgo de una infección grave por covid-19, pero es posible que no sean para todos los que anteriormente eran elegibles. Casi tres cuartas partes de los estadounidenses de 6 meses o más tienen al menos una de estas condiciones médicas subyacentes, según los Centros para el Control y la Prevención de Enfermedades de EE.UU. (CDC, por sus siglas en inglés).
El cambio, que ya estaba siendo estudiado por expertos que asesoran a los CDC sobre sus recomendaciones de vacunas, alineará más estrechamente a Estados Unidos con las pautas en el Reino Unido, Canadá y Australia.
Pero millones de adultos y niños sanos podrían perder el acceso a las vacunas actualizadas bajo los nuevos criterios. Prasad y Makary dicen que no hay suficiente evidencia de que los niños y adultos sanos obtengan un beneficio clínicamente significativo de las vacunas regulares contra el covid-19, y quieren ver más ensayos controlados con placebo, particularmente en adultos de 50 a 64 años, antes de recomendar las vacunas para otros grupos.
LEER MÁS ► Último partido de Kevin De Bruyne en el Etihad: así fue su emotiva despedida del Manchester City
No está claro si los fabricantes de vacunas contra el covid-19, incluidos Pfizer, Moderna y Novavax, decidirán realizar los ensayos controlados aleatorios que la FDA está buscando para ciertos grupos de edad. Este tipo de estudios son costosos y generalmente toman meses o incluso años.
Moderna dijo en un comunicado el martes: “Apreciamos la orientación clara de la FDA y seguimos comprometidos a trabajar con la agencia para proporcionar los datos que necesitan para garantizar el acceso para los estadounidenses”.
Pfizer y Novavax no respondieron a las solicitudes de comentarios sobre el nuevo marco regulatorio de la FDA.
Pocos días antes del anuncio de la FDA, se aprobó la vacuna contra el covid-19 de Novavax, que estaba seis semanas después de su fecha límite de aprobación planificada. La FDA restringió el uso de la vacuna a personas de 65 años o más y a aquellos de 12 años en adelante con condiciones de salud subyacentes.
“La investigación de mercado y las estadísticas de los CDC de EE.UU. indican que las personas mayores y aquellas con condiciones subyacentes son las poblaciones más propensas a buscar la vacunación contra el covid-19 de manera estacional”, dijo en ese momento el presidente y CEO de Novavax, John Jacobs. “Este hito significativo demuestra nuestro compromiso con estas poblaciones y es un paso importante hacia la disponibilidad de nuestra opción de vacuna basada en proteínas”.